血管紧张素转化酶2(ACE2)是新冠病毒SARS-CoV-2侵入细胞的主要受体,而它原本的功能主要起调节心率和血压的作用。有趣的是,ACE2两种功能间存在紧密联系,例如,SARS-CoV-2感染的仓鼠和新冠重症患者通常会出现心脏损伤,如心律失常、心力衰竭等。蝙蝠是哺乳动物中唯一能真正飞行的类群,同时也被称为“天然病毒库”。它们演化出了一系列与ACE2两个功能都密切相关的适应性表型。一方面,飞行能力的起源和演化促使蝙蝠的心脏功能变强,心率调控能力增加。另一方面,尽管携带了多种可以引起人类传染病的冠状病毒,但是蝙蝠自身很少或不会表现出患病的明显症状。这些现象提示着,蝙蝠共同祖先ACE2可能经历了自然选择作用,影响了与蝙蝠飞行和抗冠状病毒相关的两种功能。
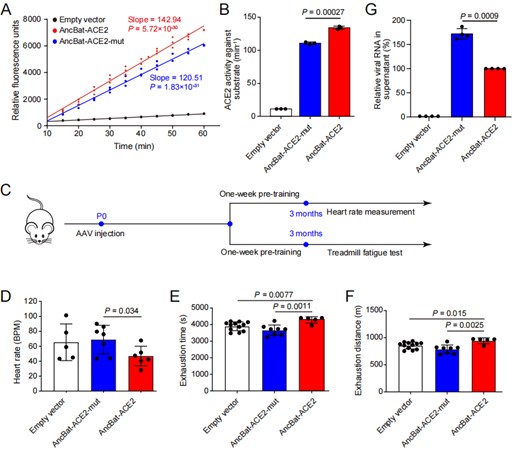
为了验证上述假说,刘振团队检测了蝙蝠祖先枝系上ACE2的选择压力情况,结果发现蝙蝠祖先ACE2(AncBat-ACE2)确实存在显著的正选择信号,并且鉴定出了10个受到正选择的氨基酸位点。为了验证这些正选择位点的功能效应,研究团队通过重建蝙蝠祖先的ACE2蛋白,以及改变祖先序列中的正选择位点的突变体(AncBat-ACE2-mut)进行实验,结果发现,与突变体(AncBat-ACE2-mut)相比,蝙蝠祖先ACE2(AncBat-ACE2)具有显著更强的酶活性。为了进一步验证ACE2在蝙蝠祖先枝系上所受选择压力对心脏功能的影响,研究团队利用心脏特异表达的腺相关病毒(AAV9)分别将AncBat-ACE2和AncBat-ACE2-mut转染至小鼠心脏中,并对这些小鼠进行运动疲劳测试。结果发现,携带AncBat-ACE2的小鼠比携带AncBat-ACE2-mut的小鼠的心率调节能力和运动能力都显著更强。进一步地,研究团队利用感染实验分别检测了AncBat-ACE2和AncBat-ACE2-mut与新冠病毒SARS-CoV-2的亲和性,结果发现,相较于AncBat-ACE2-mut,AncBat-ACE2与SARS-CoV-2的亲和力显著更低。这些结果表明,自然选择对蝙蝠祖先ACE2两种功能造成了影响,提示着蝙蝠的飞行演化与抗冠状病毒之间的协同演化关系,该结果为蝙蝠如何进化出防御冠状病毒的机制提供了新的理解。
该研究成果近日以“Pleiotropy of positive selection in ancient ACE2 suggests an alternative hypothesis for bat-specific adaptations to host coronaviruses”为题发表在PNAS期刊上,原文信息及链接为:https://www.pnas.org/doi/10.1073/pnas.2321619121。 郭媛婷和蒋继滨以及昆明医科大学乔冠荣为论文共同第一作者。 刘振研究员和昆明医科大学郑昌博副教授为论文通讯作者。该研究工作得到了国家重点研发计划、国家自然科学基金、中国科学院相关项目的资助。